|
Содержание
< назад вперед >
ГЛАВА ТРЕТЬЯ. ХИМИЧЕСКИЕ ДЕЙСТВИЯ ЭЛЕКТРИЧЕСКОГО ТОКА
§ 19. ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ
До сих пор мы рассматривали
случаи, когда электрический ток проходит через металлические проводники. При
этом прохождение электрического тока обусловлено упорядоченным движением свободных
электронов. При прохождении электрического тока через металлические проводники
переноса частиц вещества самого проводника не происходит. Такие проводники
называются проводниками первого рода.
Рассмотрим теперь процесс
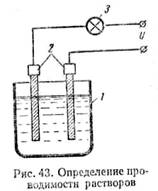
прохождения тока через жидкости. Соберем схему, показанную на рис. 43. В сосуд
1 налита дистиллированная вода. В воду опущены два
угольных стержня 2 (электроды). В цепь включена лампа накаливания 3. При подаче
напряжения на зажимы цепи лампа гореть не будет. Значит чистая вода тока не
проводит. Если бросить в воду щепотку поваренной соли, то лампа ярко загорится.
Следовательно, раствор поваренной соли в воде хорошо проводит
электрический ток. Водные растворы всех кислот, щелочей и солей проводят
ток. Вещества, растворы которых проводят электрический ток,
называются электролитами. Соли
и щелочи проводят ток не
только в
растворе, но и в расплавленном состоянии.
Чем же объясняется
способность электролитов проводить электрический ток?
Рассмотрим пример с
поваренной солью —- NaCI. В твердом виде атомы поваренной соли — натрий
Na и
хлор Сl — сильно притягиваются друг к другу и не могут свободно
перемещаться.
Поэтому поваренная соль в твердом виде тока не проводит.
При растворении поваренной
соли в воде силы взаимодействия между атомами соли ослабевают и молекула соли
распадается на две заряженные частицы — ионы: положительно заряженный ной Na+
и отрицательно заряженный
ион С1-. Раствор становится электропроводным.
Рассмотрим второй пример.
Твердые кристаллы щелочи — едкого натра NaOH — также не проводят тока. При растворении едкого натра в воде образуются положительные ионы Na+ и
отрицательные ионы ОН.
И, наконец, третий пример.
Чистые кислоты неэлектропроводны. Но при растворении в воде они становятся
электролитами, т. е. начинают проводить ток. Так, например, соляная кислота НС1
в водном растворе образует положительные ионы Н+ и отрицательные ионы С1-.
Распад электролита на ионы
при растворении его в воде называется электролитической диссоциацией.
При растворении в воде сахара
происходит только распад кристаллов, и ионов не образуется. Поэтому раствор
сахара тока не проводит.
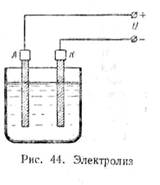
Нальем в сосуд электролит,
опустим в него два угольных электрода и пропустим через раствор постоянный
ток. Электрод, соединенный с положительным
зажимом источника энергии, называется анодом (А), а электрод,
соединенный с отрицательным зажимом — катодом (К) (рис. 44). Через некоторое время на электродах будут заметны
оседающие продукты разложения электролита. Химический анализ показывает, что
на электродах выделяются атомы вещества, растворенного в воде. Так, например,
при пропускании тока через раствор медного купороса CuS04 на одном
электроде будет выделяться медь Сu, а на другом
электроде — сернокислотный остаток S04.
Как показывают опыты, на
отрицательном электроде — катоде — всегда выделяются водород и металлы.
Процесс разложения
электролита при пропускании через него электрического тока называется электролизом.
Разложение электролита под
действием тока показывает, что внутри электролита происходит движение атомов
или групп атомов, представляющее собой части молекулы растворенного вещества.
Как было указано выше,
молекулы некоторых веществ при растворении распадаются на положительные и
отрицательные ионы. До тех пор пока через электролит не проходит ток, ионы, а
также молекулы раствора совершают хаотическое тепловое движение. При подаче
напряжения на зажимы цепи между электродами, опущенными в электролит,
возникает электрическое поле. Под действием поля возникает упорядоченное
движение ионов различных знаков в противоположные стороны: положительных — к
катоду (К), отрицательных — к аноду (Л). При соприкосновении с катодом
положительные ионы получают недостающие им электроны и оседают на катоде в виде
нейтральных атомов. Отрицательные ионы, подходя к аноду, отдают ему избыточные
электроны и превращаются в нейтральные атомы.
Итак, электрический ток в
электролитах представляет собой движение положительных и отрицательных ионов. В
отличие от металлических проводников, которые не разлагаются током и называются
проводниками первого рода, электролиты называются проводниками второго
рода.
Содержание
< назад вперед >
| 
