<< Предыдущая |
Содержание |
Следующая >>
Аккумуляторы
§ 29. АККУМУЛЯТОРЫ
Аккумулятором называется прибор,
обладающий способностью накапливать и
сохранять в течение некоторого времени электрическую энергию в результате
химических процессов.
В аккумуляторе, как и в
гальваническом элементе, электрический ток является следствием химических
процессов. Но в отличие от аккумулятора в гальваническом элементе получающиеся
химические соединения не могут быть вторично разложены и приведены в первоначальное
состояние током постороннего источника. Поэтому гальванические элементы
называются первичными, а аккумуляторы — вторичными или обратимыми. Повторные
заряд и разряд не 1 только не вредят аккумулятору, но даже улучшают его
свойства, так как в работе участвуют все
более глубокие слои пластин электродов.
В зависимости от состава
электролита аккумуляторы могут быть кислотными и щелочными. Простейший
кислотный аккумулятор состоит из двух
свинцовых пластин (электродов), погруженных в электролит,
которым служит вода с небольшим добавлением серной кислоты.
Постоянный ток постороннего
источника, проходя через электролит, разлагает его на составные части. Внутри
электролита возникает движение положительных ионов водорода Н2 к
пластине, соединенной с отрицательным зажимом источника тока, и отрицательных
ионов кислорода О к пластине, соединенной с положительным зажимом источника
тока. В результате электролиза окисляется свинец на положительном электроде и
образуется губчатый свинец на отрицательном электроде.
 Таким
образом электрическая энергия
преобразовывается в химическую и аккумулятор становится заряженным. Таким
образом электрическая энергия
преобразовывается в химическую и аккумулятор становится заряженным.
Химическая энергия может
сохраняться определенное время и при надобности легко переходит в
электрическую.
Если аккумулятор
отключить от источника тока и замкнуть
на какой-нибудь приемник энергии, то аккумулятор сам станет источником тока
подобно гальваническому элементу, у которого электродами служат пластины,
отличающиеся друг от друга по химическому составу
Электролитом в кислотных
аккумуляторах, как указывалось выше, служит раствор серной кислоты определенной
плотности. Плотностью раствора или его удельным весом называется число,
показывающее, во сколько раз вес этого раствора больше веса воды того же
объема.
Для наполнения стационарных
аккумуляторов употребляют раствор серной кислоты плотностью 1,21 при 15° С. Для
переносных аккумуляторов применяют раствор серной кислоты плотностью 1,26.
Плотность электролита
определяют ареометром. Он представляет собой стеклянную трубку, запаянную с
обеих концов и имеющую внутри шкалу с делениями. В нижней расширенной части
ареометра находится ртуть или дробь, в результате чего трубка плавает вертикально.
Ареометр опускают в сосуд с электролитом. Чем больше плотность электролита, тем
выше поднимается ареометр из жидкости. Деление ареометра, расположенное на
уровне раствора, показывает плотность электролита.
При составлении раствора для
аккумуляторов серную кислоту тонкой струей наливают в воду. Нельзя вливать в
серную кислоту воду, так как произойдет бурное разбрызгивание кислоты, которая
может причинить ожоги. Вода для электролита должна быть дистиллированной.
Внутреннее сопротивление
аккумуляторов очень мало по сравнению с внутренним сопротивлением
гальванических элементов. Это дает возможность считать напряжение на зажимах
аккумуляторной
батареи примерно равным ее э. д. с. Однако внутреннее сопротивление не является
постоянной величиной. Оно определяется составом пластин, расстоянием между
ними, плотностью и температурой электролита, степенью заряженности
аккумулятора. Так, сопротивление разряженного аккумулятора примерно в полтора-
два раза больше, чем заряженного.
Э. д. с. аккумулятора зависит
от плотности электролита и не зависит от его размеров и номинальной емкости.
При плотностях электролита
d в пределах 1,1—1,35 э. д. с. аккумулятора
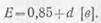
В процессе заряда и разряда
аккумулятора плотность электролита не остается постоянной, в связи с этим
изменяется как его э. д. с, так и напряжение на его зажимах.
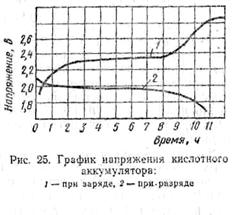
При заряде кислотного
аккумулятора напряжение его сравнительно быстро возрастает до 2,2 в (рис. 25,
кривая 1), затем медленно достигает 2,3 в, после чего довольно быстро
возрастает до 2,6 в и, наконец, медленно
увеличивается до 2,7—2,75 в и выше не поднимается.
По достижении напряжения 2,2
в у отрицательной пластины аккумулятора начинают выделяться пузырьки водорода,
а при 2,3 в около положительной пластины появляются пузырьки кислорода.
При 2,5 в около обеих пластин происходит обильное выделение газов, а когда
напряжение достигает 2,6—2,75 в аккумулятор, как говорят, начинает «кипеть». I
При заряде аккумулятора
увеличивается плотность электроли-1 та, вследствие чего напряжение на зажимах
аккумулятора повышается. При напряжении 2,4—2,5 в аккумулятор полностью зарядится (заканчивается процесс
восстановления активной массы). При дальнейшем процессе заряда
происходит электролиз воды, при котором
пластины аккумулятора покрываются пузырьками
водорода и кислорода, что уменьшает активную поверхность пластин,
увеличивая внутреннее сопротивление аккумулятора, вследствие чего увеличивается
напряжение на его зажимах. Так
как бурное выделение кислорода и водорода разрушает пластины, то в конце заряда
следует уменьшить силу зарядного тока.
При разряде кислотного
аккумулятора напряжение на его зажимах быстро падает до 2—1,95 в (рис. 25,
кривая 2), затем медленно понижается до 1,86—1,8 в и после этого снова быстро
уменьшается до нуля.
Понижение напряжения при
разряде аккумулятора объясняется тем, что при разряде плотность его электролита
уменьшается. Когда напряжение на аккумуляторе достигает значения 1,8 в (при
кратковременном разряде 1,75 в), это значит, что вся запасенная в нем энергия
израсходована (на обеих пластинах образуется сернокислый свинец, являющийся
плохим проводником тока). При дальнейшем разряде напряжение быстро уменьшается
до нуля. Если аккумулятор отключить от нагрузки, то его напряжение вновь
увеличится примерно до 2 в, так как электролит проникает в глубь
пластин в поры активной
массы. Однако при включении такого аккумулятора вновь на нагрузку напряжение
на его зажимах опять быстро уменьшится до нуля.
Практически разряд доводят
только до 1,8 в, так как при разряде ниже 1,8 в аккумулятор приходит в
негодность — пластины его частично покрываются белым налетом
крупнокристаллического сернокислого свинца, который представляет собой
настолько плохой проводник, что заряд аккумулятора до номинальной емкости
становится невозможным. Это явление называется сульфатацией пластин
аккумулятора.
Количество электричества,
которое аккумулятор может отдать при разряде определенным током до наинизшего
допустимого напряжения, называется его емкостью.
Она равна произведению разрядного тока в амперах на продолжительность времени
разряда в часах и выражается в ампер-часах.
Емкость аккумулятора зависит
от количества активной массы, величины тока и температуры. Под номинальной
емкостью понимают то количество электричества, которое отдает полностью заряженный
аккумулятор при 10-часовом режиме разряда и температуре 25° С. Таким образом,
аккумулятор отдает номинальную емкость, разряжаясь в течение 10 ч током,
численно равным 0,1 величины его номинальной емкости. При увеличении
разрядного тока емкость аккумулятора уменьшается, так как поверхность пластин
покрывается сернокислым свинцом и затрудняет доступ электролита к внутренним
слоям активной массы. При понижении температуры увеличивается вязкость
электролита, что также затрудняет его доступ к внутренним слоям активной массы
и уменьшает емкость аккумулятора.
В отключенном состоянии
заряженный аккумулятор теряет часть запасенной им емкости. Это явление носит
название саморазряда. Саморазряд аккумулятора увеличивается с повышением температуры
и плотности электролита.
Положительные пластины
кислотных аккумуляторов изготовляют преимущественно поверхностными из свинца с
глубокими бороздами для увеличения поверхности.
Отрицательные пластины
кислотных аккумуляторов выполняют коробчатыми. Они представляют собой решетку,
в ее ячейках помещается активная масса (свинцовый глет); активную массу закрывают
сеткой. Положительные пластины имеют темно-коричневый цвет, отрицательные —
светло-серый.
Для увеличения емкости аккумулятора
несколько одноименных пластин соединяют параллельно (рис. 26). Каждая группа
положительных и отрицательных пластин работает как одна большая пластина,
площадь которой равна сумме площадей параллельно соединенных пластин. Так как
положительные пластины должны находиться между отрицательными, число
отрицательных пластин всегда на одну больше числа положительных. При этом
условии обе стороны положительных пластин вступают во взаимодействие с
электролитом (при односторонней работе положительные пластины коробятся и при
соприкосновении с отрицательными пластинами может произойти короткое
замыкание).
Стационарные кислотные аккумуляторы
изготовляют в стеклянных или керамических сосудах. Аккумуляторы больших
емкостей имеют сосуды деревянные, выложенные внутри свинцом или
кислотостойким изоляционным
материалом. Кислотные аккумуляторы применяют на электротехнических установках
стационарного типа и на автотранспорте. В качестве переносных аккумуляторов
используют преимущественно щелочные аккумуляторы.
Сосуды щелочных аккумуляторов
сваривают из тонкой листовой стали и с наружной стороны никелируют. В центре
крышки сосуда имеется отверстие для заливки аккумуляторов электролитом.
Э. д. с. щелочных
аккумуляторов зависит от состояния активной массы пластин. От температуры и
плотности электролита э. д. с. зависит, незначительно и только при низких
температурах, близких к нулю, она резко изменяется; Напряжение в конце заряда
аккумулятора равно »1,8 в, по окончании заряда 1,5—1,55в;
э. д. с. разряженного аккумулятора
1,27—1,3 в. Напряжение в конце разряда щелочных аккумуляторов зависит от режима
разряда и составляет 1,1 в при
8-часовом, 1 в при 5-часовом, 0,8 в при 3-часовом и 0,5 в при 1-часовом разряде.
Внутреннее сопротивление
щелочного аккумулятора значительно больше внутреннего сопротивления кислотного.
Достоинством щелочных
аккумуляторов является то, что они не требуют тщательного ухода, не боятся сотрясений,
могут длительно оставаться в разреженном состоянии, выносят короткие замыкания,
которые для кислотных
аккумуляторов представляют большую опасность. Саморазряд у щелочных
аккумуляторов меньше, чем у кислотных.
Работу аккумулятора
характеризуют его отдача по емкости и отдача по энергии.
Количество электричества
Q,
полученное аккумулятором во время заряда, называется емкостью аккумулятора при
заряде:
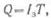
где
I3 — ток при заряде, а, Т — продолжительность заряда, ч.
Количество электричества
q, отданное
аккумулятором во время разряда, называется емкостью аккумулятора при разряде.
Если обозначить разрядный ток
Iр, а продолжительность разряда
t, то емкость аккумулятора при разряде
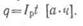
Отношение емкости при разряде
к емкости при заряде называется отдачей аккумулятора по емкости η1
или по количеству электричества.
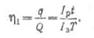
Среднее значение η1
для кислотных аккумуляторов — 0,85, а для щелочных — 0,65.
Если обозначить среднее
значение напряжения аккумулятора при его заряде
U 3
время заряда Т, то при
зарядном токе I3 электрическая энергия или работа, затраченная на
заряд аккумулятора,
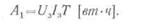
Соответственно электрическая
энергия, полученная от разряда аккумулятора при среднем напряжении
U
p и
разрядном токе I
p в
течение t (ч), составит:
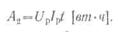
Отношение энергии, полученной
от аккумулятора при его разряде, к энергии, затраченной на его заряд,
называется отдачей аккумулятора по энергии η2
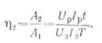
Среднее значение щ для
кислотных аккумуляторов — 0,65, а для щелочных — 0,45.
В зависимости от материала
электродов щелочные аккумуляторы могут быть кадмиево-никелевые,
железо-никелевые, серебряно-цинковые, золото-цинковые и газовые.
Применение в массовом
масштабе золото-цинковых аккумуляторов ограничивается их высокой стоимостью.
Газовые аккумуляторы
отличаются легкостью и дешевизной, но технология их производства недостаточно
разработана.
Наиболее широкое
распространение получили кадмиево-никелевые (КН) и железо-никелевые (ЖН)
аккумуляторы, электролитом которых служит раствор едкого калия в воде;
плотность электролита 1,2. По своему устройству и электрическим данным
аккумуляторы КН и ЖН незначительно отличаются друг от друга. Активную массу
запрессовывают в брикеты (пакеты)/а затем из брикетов собирают отдельные
пластины. У аккумуляторов типа ЖН отрицательных пластин на одну больше, чем
положительных. У аккумуляторов типа КН положительных пластин на одну больше,
чем отрицательных. Один из полюсов аккумулятора соединяется с сосудом (У ЖН —
отрицательный, а у КН — положительный полюс).
В кадмиево-никелевых
аккумуляторах активная масса положительных пластин состоит из гидрата окиси
никеля, который для лучшей проводимости смешивают с графитом. Активная масса
отрицательных пластин представляет собой гидроокись кадмия и железа.
В настоящее время широко
используют аккумуляторы с пористыми пластинами, которые отличаются от обычных
кадмиево-никелевых устройством пластин из порошкообразного никеля. Такие
пластины дают возможность уменьшить внутреннее сопротивление аккумулятора в 10
раз по сравнению с внутренним сопротивлением обычного аккумулятора. Поэтому
аккумуляторы с пористыми пластинами могут работать при больших разрядных токах
в кратковременном режиме.
 В железо-никелевых аккумуляторах активной массой
положительных пластин является гидрат закиси никеля, смешанный с
графитом, а отрицательных пластин — специально приготовленный железный порошок. В железо-никелевых аккумуляторах активной массой
положительных пластин является гидрат закиси никеля, смешанный с
графитом, а отрицательных пластин — специально приготовленный железный порошок.
Благодаря
высоким эксплуатационным показателям за последние годы нашли широкое
применение серебряно-цинковые аккумуляторы. Серебряно-цинковый аккумулятор
представляет собой пластмассовый сосуд, в котором помещены положительные и
отрицательные электроды, составленные из отдельных пластин. Отрицательные
электроды, изготовленные из пластин окиси цинка, заключены в защитные пакеты
из материала, который хорошо пропускает электролит, но задерживает
металлические частицы. Положительные пластины изготовлены из чистого серебра.
Электроды жестко соединены с выводными зажимами, надежно удерживающими пластины
внутри сосуда. При таком креплении отпадает надобность в поддерживающих
сепараторах и решетках, которыми обычно фиксируют положение пластин в
аккумуляторах различных типов.
Электролитом
серебряно-цинковых аккумуляторов служит водный раствор едкого калия. Для
нормальной работы аккумулятора
необходимо небольшое количество электролита, что позволяет использовать
аккумулятор полусухим и эксплуатировать его в любом положении
(вертикально и горизонтально). Трубка,
которой закрывается сосуд, водонепроницаема и открывается только на
время заряда. При заряде аккумулятор должен находиться в вертикальном
положении. Э. д. с. полностью заряженного аккумулятора равна 1,82—1,86 в, напряжение при разряде - примерно 1,5
в.
Достоинством
серебряно-цинковых аккумуляторов является малое внутреннее сопротивление; они
значительно легче (в 4—6 раз) и меньше по объему, чем кислотные и щелочные.
Серебряно-цинковые
аккумуляторы работают при температуре до -59° С, т. е. до замерзания
электролита. Верхний предел температуры - +80°С. Они переносят относительно
большие перепады
давления
окружающей среды.
Особенно
заметны преимущества серебряно-цинковых аккумуляторов перед аккумуляторами
других типов при кратковременных разрядах, так как они допускают большие
разрядные токи. Например, аккумулятор емкостью 0,5 а·ч может допустить кратковременно ток до 600 а.
Для составления
аккумуляторной батареи несколько элементов соединяют последовательно, т. е.
катод первого аккумулятора соединяют с анодом второго, катод
второго — с анодом третьего и т. д. Получившиеся таким образом
свободные электроды, а именно: анод первого элемента и катод последнего
являются соответственно
положительным и отрицательным полюсами аккумуляторной батареи. При определении э. д. с.
аккумуляторной батареи из кислотных аккумуляторов
принимают э. д. с. одного элемента, равную 2 в. Следовательно, если в состав
аккумуляторной батареи входит п элементов, то ее э. д. с.
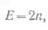
а внутреннее сопротивление
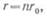
где
r0 —
внутреннее сопротивление одного элемента.
Последовательное соединение
элементов используется для увеличения напряжения.
Аккумуляторы можно соединить
параллельно, для чего положительные и отрицательные полюсы всех элементов
соединяют между собой отдельно. Полученные общие положительный и отрицательный
полюсы являются полюсами батареи.
Если батарея состоит из
m
параллельно соединенных аккумуляторов, то ее э. д. с.
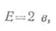
а внутреннее сопротивление
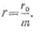
Параллельное соединение
аккумуляторов применяют в том случае, если от батареи требуется получить при
малом напряжении ток, превышающий допустимый ток одного аккумулятора.
Для всякого типа аккумулятора
установлены определенные зарядный и разрядный токи, которые зависят от
размеров пластин. Эти токи обычно указываются аккумуляторным заводом.
Если батарея состоит из
n
последовательно и m параллельно соединенных кислотных аккумуляторов, то
ее э. д. с. Е = 2 в, а внутреннее сопротивление 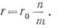
Э. д. с. щелочного
аккумулятора в значительной степени меняется с изменением степени его
заряженности. Поскольку э. д. с. щелочного аккумулятора меньше, чем кислотного,
для получения одинаковых э. д. с. батарея щелочных аккумуляторов должна иметь
больше последовательно соединенных элементов, чем батарея кислотных аккумуляторов.
Пример 1.
Кислотный аккумулятор СК-2 имеет емкость 72 а·час при десятичасовом
разряде и отдачу по емкости η1=0,85. Определить ток для заряда
аккумулятора в течение шести часов; энергию, отданную аккумулятором при разряде
и полученную им при заряде; отдачу аккумулятора по энергии, если среднее
напряжение при заряде 2,35 в и при разряде 1,9 в.
|
Энергия, отданная
аккумулятором при разряде,
|
|
Энергия, полученная аккумулятором при заряде,
|
Решение.
Зарядный ток аккумулятора
|
Отдача
аккумулятора по энергии
|
Пример 2. Для электропитания автоматической
телефонной станции требуется постоянный
ток при напряжении 60 в. Определить число кислотных аккумуляторов,
соединенных последовательно в батарею, чтобы она в конце разряда обеспечила
нужное напряжение.
Решение. Так как напряжение кислотного аккумулятора в конце
разряда равно 1,8 в, то число аккумуляторов в батарее должно быть:
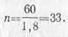
<< Предыдущая |
Содержание |
Следующая >>
| 
