<< Предыдущая |
Содержание |
Следующая >>
Химическое действие электрического тока
§ 27. ХИМИЧЕСКОЕ ДЕЙСТВИЕ ЭЛЕКТРИЧЕСКОГО
ТОКА
Растворы
солей и кислот в воде или в каком-либо другом растворителе проводят
электрический ток и называются электролитами или проводниками второго рода в
отличие от металлических проводников, называемых проводниками первого рода.
Электрический
ток может проходить через среды, имеющие электрически заряженные частицы,
обладающие способностью перемещаться.
При
растворении солей и кислот в воде или в каком-либо ином растворителе (этиловый
спирт, бензин, бензол и др.) часть молекул распадается на две части, называемые
ионами, причем одна часть имеет положительный заряд, другая — отрицательный
заряд.
Таким образом, в отличие от
металлических проводников, где переносчиками электричества являются электроны,
в электролитам ими служат ионы. Ионы могут быть простыми и сложными. Простой
ион образован одним атомом вещества. Ионы, состоящие из нескольких атомов,
называются сложными.
Распад химических соединений
на ионы под действием растворителя называется электролитической диссоциацией и
выражается обычными химическими уравнениями, в левой части которых помещаются
химические символы распадающихся веществ, а в правой — образующиеся из этих
веществ ионы. Например, уравнение
диссоциации поваренной соли (хлористого натрия) записывается следующим образом:
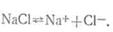
Для более сложных
соединений процесс диссоциации
может протекать в несколько стадий.
Если в сосуд с электролитом
погружены две металлические пластины, называемые электродами, которые при
помощи проволочных проводников присоединены к источнику энергии постоянного
тока, то вследствие разности потенциалов между электродами, через электролит
будет протекать ток. Прохождение тока через электролит сопровождается
химическим процессом, называемым электролизом. Находящиеся в электролите ионы,
притягиваясь к электродам, двигаются в противоположных направлениях: положительные
ионы — к катоду, а отрицательные ионы — к аноду. Подойдя к катоду,
положительные ионы получают от него недостающие им электроны и образуют
электрически нейтральные атомы. На аноде происходит обратный процесс:
отрицательные ионы отдают аноду свои избыточные электроны. Например, при
электролизе раствора поваренной соли на катоде отлагаются положительные ионы
натрия, а на аноде — отрицательные ионы хлора.
В результате непрерывного
перехода электронов с катода на ионы и поступления их на анод поддерживается
движение электронов в проводах, соединяющих источник электрической энергии с
электродами.
При прохождении
электрического тока через электролит на электродах выделяются определенные
количества веществ, содержащихся в виде химического соединения в электролите.
Зависимость выделенного вещества от силы тока устанавливается двумя законами
Фарадея.
Первый закон Фарадея
сформулирован так: количество вещества,
выделившегося на электродах при прохождении тока через электролит, прямо
пропорционально количеству электричества, прошедшему через электролит. При
прохождении одного кулона электричества из электролита выделяется определенное
весовое количество вещества, которое называется электрохимическим эквивалентом
данного вещества.
В практических расчетах для
определения количества электричества удобнее пользоваться не кулонами, а
ампер-часами (а·ч). Так как один кулон равен ампер-секунде, то между ампер-часом и
рулоном имеет место следующее соотношение:
1 а·ч = 60х60 = 3600 а·сек = 3600 к.
Электрохимический эквивалент
выражается в граммах, отнесенных к одному ампер-часу количества электричества (г/а-ч),
т. е. это весовое количество вещества, выделившегося из электролита и выраженное в граммах, при прохождении через
электролит одного ампер-часа количества электричества.
Обозначив через
I неизменную
силу тока, протекающего через электролит в течение
t (ч), а электрохимический эквивалент данного вещества
через К, определим весовое количество
данного вещества q (r),
выделившегося за это время:
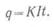
Например, если при
прохождении через меднокислый электролит тока в 1 а в течение одного часа на
катоде выделяется 1,186 г
меди, то при силе тока в 10 а из
такого же раствора за 10 ч выделится
1,186·10·10= 118,6 г.
Второй закон Фарадея гласит:
при одном и том же количестве электричества,
протекающего через различные электролиты, весовые количества веществ,
выделившихся на электродах, пропорциональны их химическим эквивалентам.
Из курса химии известно, что
одновалентный элемент имеет атомный вес, равный химическому эквиваленту, а
n-валентный элемент обладает химическим эквивалентом,
в n раз меньшим атомного веса, т. е.
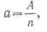
где
A-атомный вес,
n- валентность, а-химический эквивалент
Например, атомный
вес алюминия А=27,
валентность n = 3, следовательно, его химический эквивалент

Из сопоставления 1-го и 2-го
законов Фарадея вытекает, что электрохимические эквиваленты пропорциональны их
химическим эквивалентам, т. е.
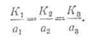
Следовательно, отношение
электрохимических эквивалентов к их
химическим эквивалентам является
величиной постоянной и равно
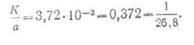
Итак, второй закон Фарадея
может быть выражен следующим образом:
Пример. Из
электролита в течение 10 ч выделилось
50 г цинка.
Определить ток, протекающий через электролит. Электрохимический эквивалент
цинка К= 1,22 г/а·
ч.
Решение, Согласно первому закону Фарадея имеем:
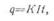
откуда
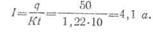
Электролиз получил широкое
применение в различных отраслях промышленности. Впервые он был использован для
гальванопластики, представляющей собой получение копий с рельефов. С этой
целью гипсовый оттиск (негатив) со снимаемого рельефа покрывают слоем графита
и погружают в раствор соли металла, который осаждается на оттиске, как на
катоде. После удаления гипса получается металлическая копия рельефа.
С помощью электролиза наносят
относительно тонкие покрытия одних металлов на другие (гальваностегия).
Гальваностегия используется для придания изделиям декоративного вида и для
защиты от коррозии. Таким способом производят золочение, серебрение,
никелирование и т. д.
Электролиз служит также для
очистки (рафинирования) металлов, например меди. Пластины литой меди,
полученной путем обжига руды, опускают в качестве анодов в ванны, содержащие
раствор медного купороса, подкисленный серной кислотой для повышения
проводимости электролита. Катодами в этих ваннах являются тонкие медные кисти,
на которых отлагается электролитическая медь, а примеси осаждаются на дно
ванны.
Весьма распространен
электролитический способ получения едких щелочей натрия, калия и хлора, а также
кислорода и водорода путем разложения воды, подкисленной серной кислотой.
Явление электролиза
представляет опасность для ряда подземных сооружений. Под действием
электролиза блуждающими токами могут быть разрушены броня кабелей,
водопроводных и газовых труб и других металлических сооружений. Главнейшим
источником этих токов является электрооборудование транспорта — трамваев и
электрифицированных железных дорог. Особенно вредно действуют блуждающие, токи
на подземные телефонные кабели, покровом которых является голая свинцовая
оболочка.
<< Предыдущая |
Содержание |
Следующая >>
| 
